Taller virtual 04 Ciencias Naturales grado 9-02- 9-03
Fecha: 26 de octubre al 20 de noviembre
Docente Juan Zapata
Tema:
Escala de pH - pOH.
Procesos propios de los seres vivos y de procesos industriales.
Relaciones cuantitativas entre solutos y solventes (insaturadas,
saturadas y sobresaturadas).
Manejo de variables (temperatura, presión, cantidad de soluto y
disolvente).
Componentes de una solución y representa cuantitativamente el grado de
concentración utilizando algunas expresiones matemáticas: % en volumen, % en
masa, molaridad (M), molalidad (m).
Puentes de Hidrogeno, fuerzas de Van der Waals.
Las propiedades físicas (solubilidad, la densidad, el punto de
ebullición y fusión y la tensión superficial) de sustancias liquidas.
Fecha: octubre 23 a noviembre 23
TEMAS:
Indicador de desempeño:
CONCEPTUALES: reconoce de manera detallada
relaciones entre los modelos de la teoría acido-base e identifica la
importancia del pH en la elaboración de productos de uso cotidiano.
PROCEDIMENTALES: identifica de manera detallada los productos que pueden tener diferentes
niveles de pH y explico algunos de sus usos en actividades cotidianas.
ACTITUDINALES: Me informo de manera
profunda para participar en debates sobre temas de interés generales de
ciencias.
Escala de pH - pOH.
Conceptos importantes para entender la importancia y los componentes del ph:
1. CONCEPTO Y COMPONENTES DE UNA SOLUCION Una solución es una mezcla homogénea de dos o más sustancias. La sustancia disuelta se denomina soluto y está presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. En cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.
2. PROPIEDADES DE LAS SOLUCIONES Las soluciones se caracterizan porque:
·
Son físicamente homogéneas. Esto significa que una vez mezclados sus
componentes, no es posible diferenciarlos uno del otro. Una vez se mezcla el
agua con la sal, no es posible diferenciar uno de otro. Esto se debe al tamaño
de sus partículas (0,1 micra a 1 micra).
·
Su composición es variable. La proporción en que se encuentran las sustancias
en la solución puede variar, sin que por ello se altere su naturaleza. Se puede
disolver una cucharada de azúcar en un litro de agua o en dos litros, igual
sigue siendo una solución de azúcar.
· Las propiedades físicas de la solución son diferentes a la del solvente puro. Así por ejemplo, al disolver en agua, el punto de ebullición de la solución es mayor que el punto de ebullición del agua pura. Esta variación depende de la cantidad de soluto disuelto.
3. CLASES DE SOLUCIONES Cualquier sustancia, sin importar el estado de agregación de sus moléculas, puede formar soluciones con otras. Las soluciones se pueden clasificar según el estado físico del solvente, o según la cantidad de soluto que contengan.
3.1. Clasificación de las soluciones de acuerdo con su solubilidad Cuando una sustancia se disuelve en otra, que actúa como solvente, se dice que es soluble en ella. Un volumen de solvente a una temperatura dada, admite una cantidad limitada de soluto. Si se añade más soluto a la mezcla, este precipitará, depositándose en el recipiente. Según la cantidad de soluto que contienen, las soluciones que pueden ser insaturadas, saturadas y sobresaturadas.
La relación entre las masas del soluto y el solvente permite establecer diferentes clases de soluciones. Se las puede clasificar según el siguiente esquema:
soluciones no saturadas: Las hay de dos tipos: · Soluciones diluidas: Cuando la masa de soluto es muy pequeña en relación a la masa de disolvente o solvente. Por ejemplo: pocos gramos de sal (ClNa) en 100 g de agua.
Soluciones concentradas: Cuando la masa de soluto es elevada con respecto a la del solvente o disolvente. Por ejemplo: 30 g de Cloruro de sodio en 100g de agua.
Soluciones saturadas: Son aquellas soluciones que a una temperatura determinada no admiten la disolución de más soluto en un solvente, es decir, es la máxima masa de soluto que se puede disolver en el solvente. Por ejemplo: En 100 g de agua a 20 ºC se pueden disolver como máximo 36 g de cloruro de sodio.
Soluciones sobresaturadas: Se producen cuando en determinadas condiciones se puede disolver una cantidad mayor de soluto que la que corresponde a una solución concentrada. Esta clase de soluciones son muy inestables y generalmente se las obtiene por enfriamiento lento de soluciones saturadas.
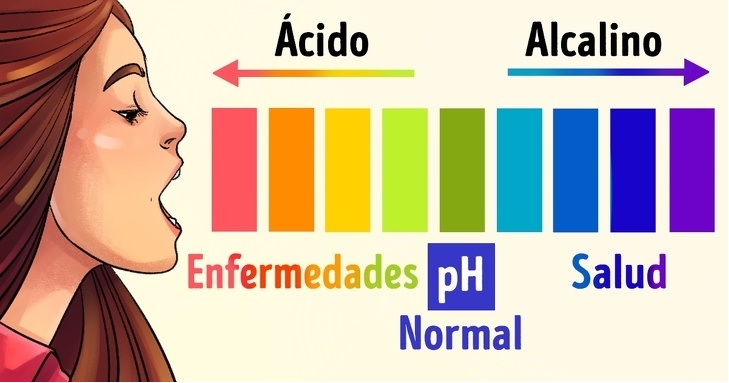
CONCEPTO DE pH
El pH (potencial de hidrógeno) es una medida de la acidez o alcalinidad de una disolución que indica la concentración de iones hidronio [H3 O+] presentes en una disolución:
pH es una medida de la acidez o la alcalinidad. La escala del pH va desde 0 a 14. El punto medio de la escala del pH es 7, aquí hay un equilibrio entre la acidez y alcalinidad. Dicha solución sería neutral.
La medida del pH es un valor que va desde 0 (máxima acidez) hasta 14 (máxima basicidad). Se considera que una disolución es neutra cuando [H3O+] = [OH–], es decir, cuando el pH = 7. Por lo tanto:
pH < 7 → disolución ácida
pH > 7 → disolución básica
pH = - log [H3O+]
También se emplea el pOH = - log [OH-] para medir la concentración de iones OH−.
Teniendo en cuanta que Kw = [H3O+] · [OH–] = 10 -14, podemos obtener la siguiente fórmula:
pH + pOH= 14
Ejemplo 1: calcular el pH de una disolución 0,5 N de hidróxido de sodio NaOH.
·
Al ser una base fuerte todo el NaOH se disocia completamente:
NaOH
→ Na+ + OH
0,5 0,5 0,5
pOH = -log [OH-] = -log [0,5] = 0,3
· pH= 14 -pOH= 14 - 0,3= 13,4
Ejemplo 2: calcular el pH de una disolución de ácido nítrico HNO3 3,8·10-4 M.
·
Al ser un ácido fuerte todo el HNO3 se disocia:
HNO3+H2O
→ H3O+ + NO3 –
3,8·10-4 3,8·10-4 3,8·10-4
H [H3O+] = 3,8 · 10-4
M
pH = - log [H3O+] = - log [3,8
· 10-4] = 3,42
· Ejemplos de ácidos
-Ácidos de baterías: se encuentran entre el 0 y el 1, su nivel de ácido es tan fuerte que es perjudicial para las especies.
-Lluvia ácida: es un fenómeno que se produce por la acumulación de ácidos provenientes de fósiles y combustibles.
En la escala de ácidos se puede ubicar entre el 5 o 2 aproximadamente, siendo el primero el que cause menor daño (por ejemplo, afectar la reproducción de peces). Ya que alcanzar el 2, puede generar la muerte de especies acuáticas. De la misma forma la flora y fauna más delicada.
-Jugo de limón: se ubica entre el 2 y el 3.
-Café: se ubica en el 5.
·
Ejemplos de neutro
-Sangre
-Leche
-Ejemplos de bases
-Leche de magnesia: en la tabla de pH se ubica entre 10 y 11. Este producto es de consumo medicinal.
-Lejía o cloro: nivel de alcalinidad 13, se usa para la limpieza del hogar, baños, cocina y tiene el poder de decolorar la ropa.
EQUILIBRIO DEL PH EN EL CUERPO
Si usted tiene un problema de salud, su cuerpo es, probablemente, demasiado ácido. La investigación ha demostrado que, si el cuerpo es ligeramente alcalino, no puede curarse. Así que cualquier método que decida utilizar para tratar su problema de salud, no será eficaz hasta que su nivel de pH vuelva a estar equilibrado. Si el pH del cuerpo no es correcto, no puede asimilar con eficacia las vitaminas, minerales y suplementos dietéticos que utilice. El pH de su cuerpo afecta el metabolismo general.
Como la mayoría de los seres vivos, el cuerpo humano debe tener un pH equilibrado de lo contrario no funcionará correctamente. El nivel de alcalinidad es muy importante porque la investigación ha demostrado que las bacterias y las enfermedades no pueden sobrevivir en un estado alcalino, mientras que se desarrollan en un ambiente ácido. Un nivel de pH ácido: disminuye la capacidad del cuerpo para absorber los minerales y otros nutrientes, la producción de energía en las células, la capacidad del cuerpo para reparar células dañadas, su capacidad para desintoxicar los metales pesados, hace que las células tumorales crezcan y que el cuerpo sea más susceptible a la fatiga y las enfermedades.
El pH ácido es el resultado de una dieta ácida, el estrés emocional, una sobrecarga tóxica, y / o reacciones inmunes o cualquier otro proceso que priva a las células de oxígeno y otros nutrientes.
Al exponerse a una situación así, el cuerpo tratará de compensarse a un pH ácido mediante el uso de minerales alcalinos. Si la dieta no contiene suficiente de este tipo de mineral, va a producir una acumulación de ácidos en las células y pone en peligro la salud de la materia.
ACTIVIDAD 1
1. ¿Qué es una solución y cuáles son sus componentes?
2. Nombro las propiedades de las soluciones.
3.Realizo un mapa conceptual de la clasificación de las soluciones.
ACTIVIDAD 2
1. Qué es el pH?
2. Cuando una disolución es neutra
3. Dibujo la escala de pH
4. Cuando una sustancia es ácida y cuando es básica
5. ¿Cuáles son las fórmulas para calcular el pH y el pOH
6. Copio los ejemplos del cálculo del pH y pOH
7. ¿Qué son indicadores de pH?
9. Consulto alimentos alcalinos y alimentos ácidos.
ACTIVIDAD 3
1.Calcular el pH y el pOH de cada una de las siguientes disoluciones:
·
Solución de HNO3 0,035 M
· Solución de H2SO4 0,1 M
2. ¿Cuál será el valor de pOH de una solución de ácido nítrico HNO3 si se determina que la concentración de [H+]= 0,01 M
Conocimientos preliminares
Masa atómica o peso atómico y masa formula.
La masa formula de un compuesto es la suma de las masa atómicas de los elementos en la fórmula del compuesto. La masa formula se usa para convertir entre el número de átomos y un masa especifica (uma) de un elemento o compuesto.
Mol o mole
Como las reacciones no se realizan gramo a gramo y si átomo a átomo o molécula a molécula, los químicos prefieren usar sus propias unidades y usar factores de conversión para expresarlas en unidades de masa. La unidad acordada por los químicos es el mol y tiene un número de partículas igual a número de átomos que hay en 12 g de carbono 12 (Isotopo de carbono 12). Después de muchos experimentos se determinó que el número de átomos en 12 g de carbono es de 6,022x1023 partículas.
Masa molar.
La masa molar (g/mol) de cualquier sustancia es la masa en gramos numéricamente igual a su masa atómica, o la suma de las masas atómicas, que se multiplicaron por sus subíndices en una formula.
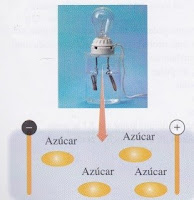
Un soluto iónico se disuelve en agua (un solvente polar) porque las moléculas polares del agua atraen y jalan los iones hacia la solución, donde se hidratan. Las sustancias que liberan iones se les llaman electrolitos porque la solución en agua conducirá la energía eléctrica. Los electrolitos fuertes se ionizan por completo mientras que los electrolitos débiles solo estarán ionizados parcialmente. Los no electrolitos son sustancias que se disuelven en agua para producir moléculas y soluciones que no conducen la corriente eléctrica.
|
Tipo de soluto |
Disociación |
Contenido en solución |
Conductividad |
Ejemplos |
|
Electrolito fuerte |
Completamente |
Solo iones |
Si |
Sales:
NaCl, KBr, KI, MgCl2, AgNO3. Bases: NaOH, KOH. Ácidos: HCl, HBr,
HNO3, H2SO4 |
|
Electrolito débil |
Parcialmente |
Parcialmente:
moléculas y algunos iones |
Sí, pero pobremente |
HF, H2O, NH3, CH3COOH |
|
No electrolito |
Ninguna |
Solo moléculas |
No |
Compuestos de
carbono: CH3OH, C2H5OH. |
Figura 1. Conducción de la electricidad por diferentes
electrolitos.
Electrolito Fuerte Electrolitos débil | No electrolito | |
Soluciones
Una solución se forma cuando un soluto se disuelve en un solvente. La expresión los iguales se disuelven significa que un soluto polar o iónico se disuelve en un solvente polar y un soluto no polar requiere de un solvente no polar para su disolución. El enlace polar OH genera puentes de hidrogeno entre las moléculas de agua.
|
Tipo |
Ejemplo |
Soluto |
Solvente |
|
Solución gaseosa |
|||
|
Gas en gas |
Aire |
Oxigeno |
Nitrógeno |
|
Soluciones liquidas |
|||
|
Gas en liquido |
Gaseosa
|
Dióxido de carbono |
Agua
|
|
Liquido en liquido |
Vinagre |
Ácido acético |
agua |
|
Solido en liquido |
Agua de mar Tintura de yodo |
Sal Yodo |
Agua Alcohol |
|
Solución solida |
|||
|
Liquido en un solido |
Amalgama dental |
Mercurio |
Plata |
|
Solido en solido |
Bronce Acero |
Zinc Carbono |
Cobre Hierro |
Solubilidad
Una solución que contiene la cantidad máxima de soluto disuelto es una solución saturada. La solubilidad de un soluto es la cantidad máxima de un soluto que se puede disolver en 100 g de solvente. Una solución que contiene menos de la cantidad máxima de soluto disuelto es insaturada. Un aumento en la temperatura aumenta la solubilidad para la mayoría de los sólidos en agua, pero reduce la solubilidad de los gases en el agua.
Figura 2. Solubilidad de algunas sustancias en agua
Las sales que son solubles en agua por lo general contienen Li+, Na+, K+, NH4+, NO3-, o COOH-. Una ecuación iónica consiste en escribir todas las sustancias disueltas en una ecuación para la formación de una sal insoluble como iones individuales. Una ecuación iónica neta se escribe al quitar todos los iones no participantes en el cambio químico (iones espectadores) de la ecuación iónica.
|
Soluble si contiene sal |
|
Insoluble si contiene sal |
|
NH4+, Li+, Na+,
K+, NO3-, CH3COOH-
|
← Pero son solubles con |
CO32- , S2- PO43-, OH- |
|
Cl-, Br-, I-
|
Pero no son solubles con → |
Ag2+, Pb2+, Hg22+ |
|
SO42- |
Pero no son solubles con → |
Ba2+, ca2+, Pb2+, Sr2+ |
Las dos sales son electrolitos fuertes por tanto estarán en el agua como iones. Las siguientes son las respectivas reacciones
|
Molecular |
AgNO3(ac) + NaCl(ac) → AgCl(s)+ NaNO3(ac) |
|
Iónica |
Ag+(ac)+ NO3-(ac) + Na+
+ Cl- → AgCl(s)+ Na+(ac) +NO3-(ac) |
|
Iónica neta |
Ag+(ac)+ Cl-
→ AgCl(s) |
Actividad 4
En el CASD se desea preparar una solución de (0,8+0,05*NL) kg yoduro de potasio, donde NL es el número de lista, en un litro de agua. Determinar si la solución está saturada o insaturada. Qué pasaría si esta solución se calienta hasta ochenta grados Celsius. Cuantos gramos de KI hay que adicionarle al litro de agua para que la solución quede nuevamente saturada. Qué precio tendría la preparación de las soluciones (se pueden usar precios internaciones por ton de KI).
Qué pasaría si a veinte grados Celsius un litro de solución saturada de KI se mezcla con 100 ml de solución (2+0,2NL) M de AgNO3, donde NL es el número de lista. Escribir las ecuaciones: molecular, iónica y iónica neta. Que precipitado se produce y cuantos gramos de precipitado se producen. Además, indicar el estado de los reactivos y productos en la reacción.
Llenar la tabla, la sustentación y demás resultados debe estar en el cuaderno.
|
Numero de lista |
|
KI adicionado @ 80 °C para saturación, g |
|
|
Kg de KI |
|
USD/ton KI |
|
|
g KI/100gH2O |
|
Peso col $/kg KI |
|
|
Solubilidad KI @ 20 °C, g KI/100gH2O |
|
Numero de lista |
|
|
Saturada/insaturada |
|
Molaridad AgNO3, mol/L |
|
|
Solubilidad KI @ 80 °C, g KI/100gH2O |
|
Peso precipitado |
|
Expresión de la concentración.
Los términos saturado o insaturado son
relativos y no permiten saber el significado exacto de las cantidades de soluto
y solvente de una solución. Debido a esto la concentración se puede expresar en
unidades de concentración físicas y en unidades de concentración químicas.
Las unidades
Por ejemplo, en la concentración molar
es la cantidad de soluto disuelto un litro de solución. El porcentaje en peso
expresa la razón de la masa de soluto a la masa de solución multiplicada por
100. La concentración en peso porcentual también se puede expresar como la
razón entre la masa y el volumen, expresado en litros.
En el caso de unidades de
concentración químicas la molaridad son los moles de soluto por litro de solución.
Las unidades de molaridad, moles/litro, se usan como factores de conversión
para resolver moles de soluto o volumen de solución. Cuando se agrega agua a
una solución, el volumen aumenta. El soluto ahora se distribuye a través de un
volumen más grande, que diluye la solución y reduce la concentración. En la
tabla se presentan las definiciones.
Valoraciones
La valoración es una reacción que se
realiza agregando una solución de reactivo de concentración conocida a una
solución de otro de concentración desconocida. El final de la valoración o
punto de equivalencia puede conocerse por el cambio de color de un indicador o
por el cambio de conductividad eléctrica.
Las valoraciones más habituales son
las de ácido-base y las de óxido-reducción. (justifica el balanceo de las
reacciones)
3HCl + Al(OH)3 →
AlCl3 + 3H2O acido-base
H2SO4 + 2NaOH →
Na2SO4 + H2O oxido-reducción
De las reacciones anteriores se puede
decir que reaccionan 1 mol de Al3+ con 3 de Cl1- o lo que
es lo mismo 3 equivalentes de HCl con 3 equivalentes de Al(OH)3. Así mismo reaccionan 2 mol de Na+
con 1 de SO42- o lo que es lo mismo 3 equivalentes de HCl con 3
equivalentes de Al(OH)3.
|
Nombre |
Expresión |
Unidades |
|
Porcentaje en peso,
%p/p |
Gramos de soluto 100 Gramos de solución |
% |
|
Concentración en
Peso, C |
Gramos de soluto litros de solución |
g/L |
|
Partes por millón,
ppm |
Miligramos de soluto Kilogramos solución |
No tiene |
|
Fracción Molar, X |
moles de soluto moles de soluto +
moles de solvente moles de solvente moles de solvente +
moles de soluto |
No tiene |
|
Molaridad, M |
moles de soluto litros de solución |
Mol/L |
|
Molalidad, m |
moles de soluto kilogramos del
solvente |
Mol/kg |
|
Normalidad, N |
Equivalentes soluto kilogramos del
solvente |
Eq g/L |
|
Formalidad, F |
Peso formula gramo
soluto V(L) |
Pfg/L |
¿Se había elegido a un ilustre dignatario para tamaño honor, se había cogido a un fulano cualquiera que pasaba por la calle, o se había sacado del laboratorio un anónimo clon de células de tejido cultivado? La cuestión es importante por la sencilla razón de que los humanos somos diferentes unos de otros. Yo tengo los ojos castaños, mientras que el lector tal vez los tenga azules. Yo no consigo doblar la lengua en forma de tubo, mientras que hay un 50 por ciento de posibilidades de que el lector sí lo consiga. ¿Qué versión del gen responsable del doblado de lengua figura en el genoma humano recién secuenciado? ¿Cuál es el color de ojos canónico? He planteado el asunto sólo para establecer un paralelismo. Este libro va en busca de los remotos antepasados humanos, pero ¿de qué antepasados estamos hablando? ¿De los del lector o de los míos? ¿De los de un pigmeo bambuti o de los de un nativo de las Islas del Estrecho de Torres? Enseguida abordaré esta cuestión, pero no quiero dejar en el aire la pregunta análoga sobre el Proyecto del Genoma Humano: ¿de quién era el genoma escogido para el análisis? En el caso del proyecto oficial, la respuesta es que, por lo que respecta al escaso porcentaje de letras del ADN que varían, el genoma canónico es el voto mayoritario de un grupo de doscientas personas escogidas de forma que representasen una amplia diversidad racial. En el caso del Proyecto rival, dirigido por el doctor Craig Venter, el genoma analizado fue en su mayor parte... el del doctor Craig Venter. El dato lo dio a conocer el propio doctor1, para ligera consternación del comité ético, que, aduciendo toda clase de motivos loables y sensatos, había recomendado que los donantes fuesen anónimos y de diversa extracción racial. Hay una serie de proyectos dedicados al estudio de la diversidad genética humana que, por increíble que parezca, son objeto de reiterados ataques políticos, como si fuese incorrecto reconocer que los seres humanos somos diferentes. Menos mal que lo somos, aunque tampoco tanto.
1. Cuando su equipo pasó a descifrar el genoma canino, nadie se sorprendió al enterarse de que el perro elegido era Shadow, el caniche del doctor Venter.
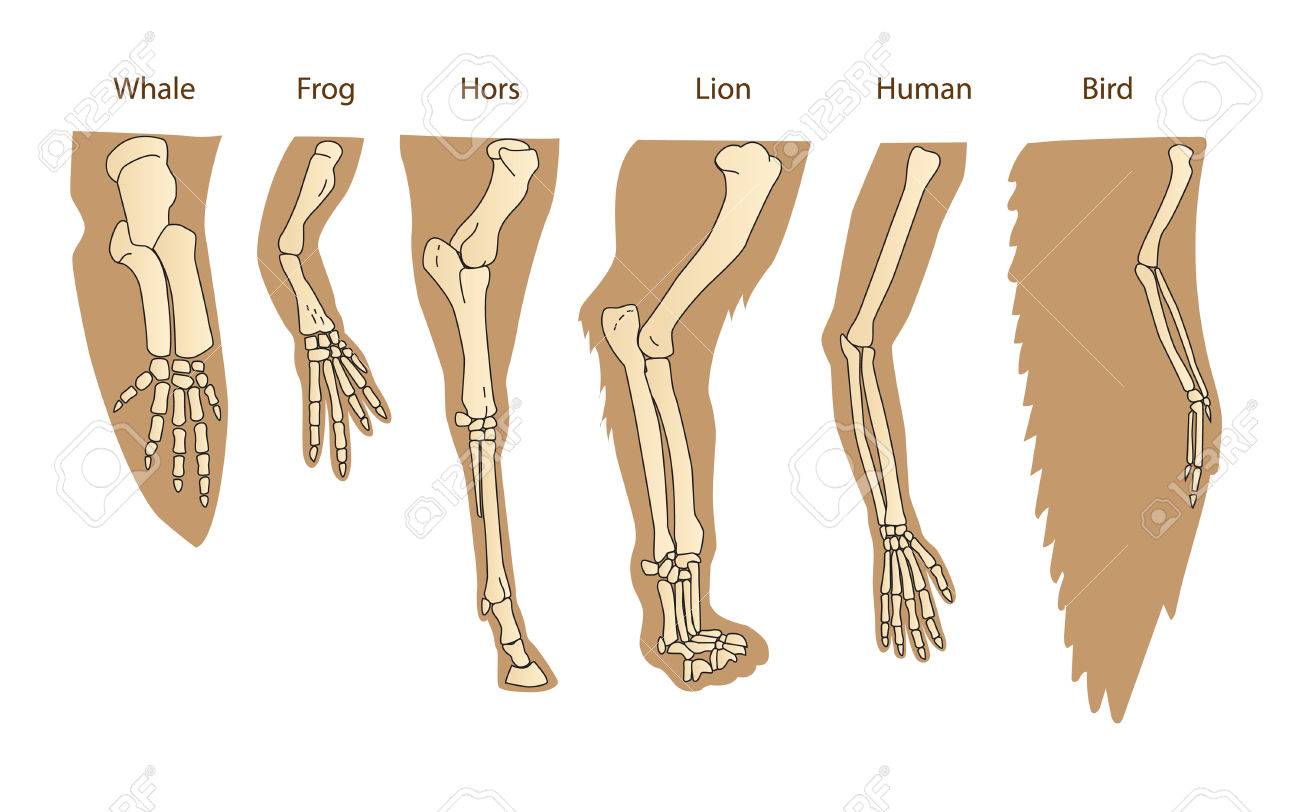
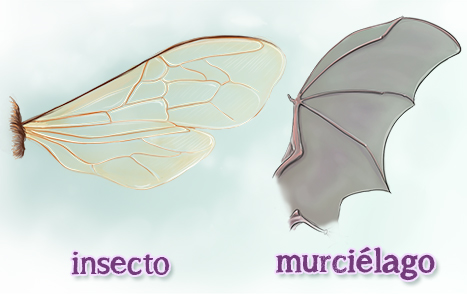
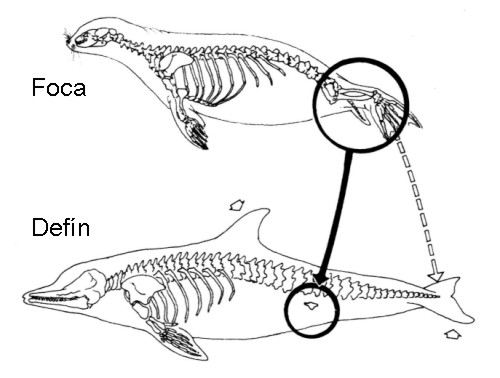
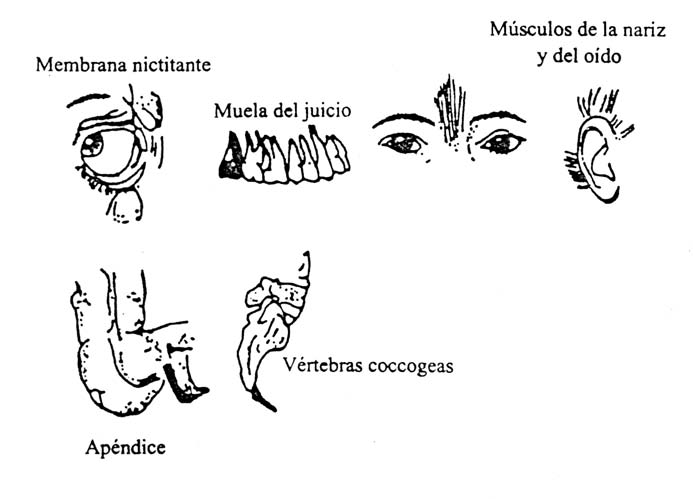
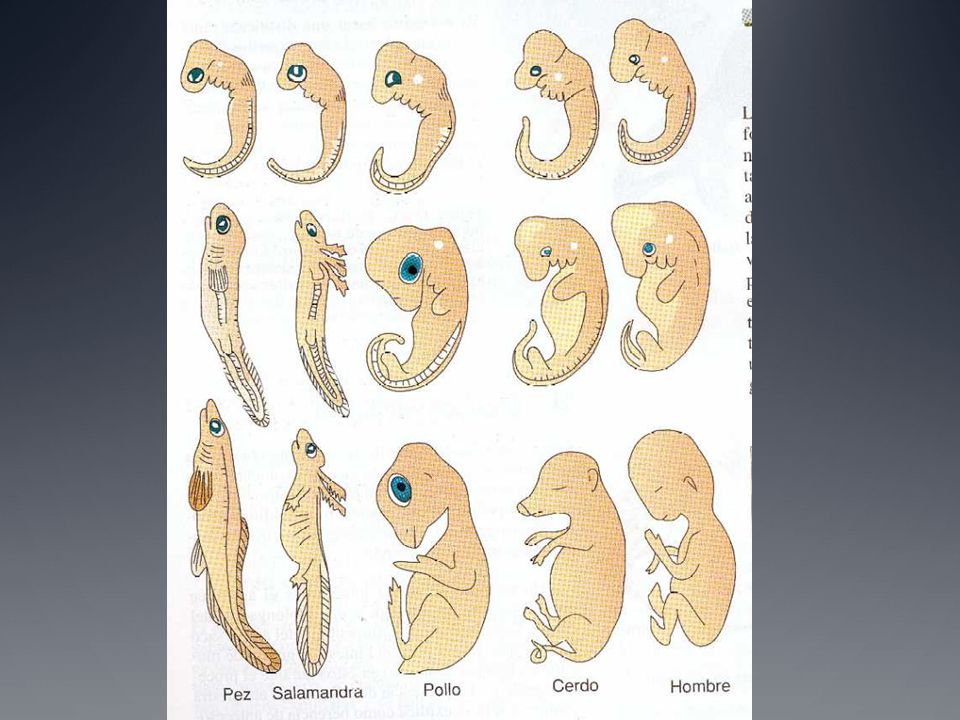
EVIDENCIA DE EVOLUCIÓN
|
ESQUEMA O DIBUJO
|
PALEONTOLÓGICAS
|
|
ANATOMÍA
COMPARADA
|
|
BIOGEOGRÁFICAS
|
|
BIOQUÍMICAS
Y MOLECULARES
|
PAREJA DE ANIMALES
|
ESTRUCTURAS
HOMÓLOGAS O ANÁLOGAS
|
FUNCIÓN DE LAS
ESTRUCTURAS
|
MARIPOSA - MURCIÉLAGO
|
||
HOMBRE - BALLENA
|
PREGUNTAS ORIENTADORAS
¿Cuáles son las relaciones entre los modelos de la teoria acido- base y la importancia del pH en la elaboración de productos de uso cotidiano?
¿Cuál es la naturaleza y las relaciones entre la fuerza y el movimiento?
Las actividades 1 y 2 del segundo periodo serán revisadas en las clase virtuales de Ciencias Naturales, programadas entre el 25 de junio y el 27 de julio de 2020. Por lo tanto debes leer bien todo el texto, ver los vídeos y también asistir a las clase virtuales convocadas por el docente donde se tendrá en cuenta la asistencia, la participación y respuestas a las diferentes preguntas o interrogantes que se harán durante la clase.
Actividad 1.
Lee el enunciado y observa los vídeos propuestos en el blog, además realiza un breve resumen.
A(rojo)
|
A(rojo)
|
|
a(morado)
|
Aa
|
Aa
|
a(morado)
|
Aa
|
Aa
|
A(rojo)
|
a(morado)
|
|
A (rojo)
|
AA
|
Aa
|
a(morado)
|
Aa
|
aa
|
A(rojo) B(liso)
|
A(rojo) b(rugoso)
|
a(morado) B(liso)
|
a(morado) b(rugoso)
|
|
A(rojo)
B (liso)
|
AABB
|
AABb
|
AaBB
|
AaBb
|
A (rojo)
b(rugoso)
|
AABb
|
AAbb
|
AaBb
|
Aabb
|
a(morado) B(liso)
|
AaBB
|
AaBb
|
aaBB
|
aaBb
|
a(morado) b(rugoso)
|
AaBb
|
Aabb
|
aaBb
|
aabb
|
Entra al siguiente link, lee los enunciados que están en la introducción y realiza los ejercicios propuestos en el simulador de la Primera, Segunda y Tercera Ley de Mendel
Conceptuales: Reconocer detalladamente la importancia del modelo de la doble hélice para la explicación del almacenamiento y transmisión del material hereditario.
Procedimentales:Explica de manera profunda la variabilidad en las poblaciones y la diversidad biológica como consecuencia de los cambios genéticos y selección natural.
Actitudinales: Resuelve de manera detallada las actividades que se proponen en el momento oportuno.
Concepto clave: El ADN debe ser compactado debido a que ocupa mucho espacio en la célula. Unas proteínas llamadas histonas se encargan de empaquetar el ADN. Luego que el ADN se enrolla alrededor de las histonas se forman espirales que se acumulan y se condensan hasta construir una estructura llamada cromosoma que se ubica en el núcleo de la célula.

http://4.bp.blogspot.com/DZtaxuTWYEs/UGNFMPS0QdI/AAAAAAAAALo/yoBjsmmvldI/s1600/%20img+de+cromosoma.JPG
| Tabla Sequya: Lea cada una de las preguntas formuladas en la columna “Lo que quiero saber”. Luego complete las columnas de la izquierda y derecha respondiendo “Lo que sé” y "lo que aprendí" | ||
| Lo que sé | Lo que quiero saber | Lo que aprendí |
¿Cuál es la relación del
ADN con la herencia?
|
||
| Si se cruza una flor amarilla con una flor roja, ¿es posible predecir el color de la nueva flor? ¿Por qué? | ||
| ¿Por qué un hijo hereda características físicas de sus padres? | ||
| Para modificar el color de los pétalos de una rosa manipulando sus células, ¿qué parte de la célula intentaría transformar? | ||
| ¿Cómo se aplica el conocimiento sobre ADN y genes en la medicina? | ||
ACTIVIDAD 2. (Plazo para enviar Abril 27 a mayo 8)
Con base en el texto y los vídeos desarrolle el siguiente ejercicio:
El reto del cromosoma
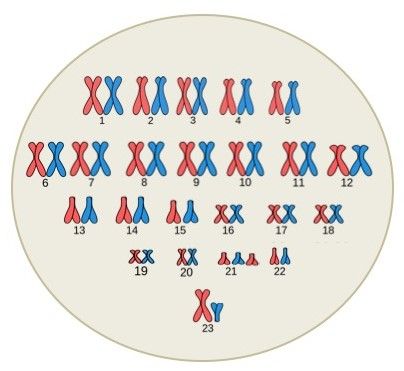
El ser humano tiene en las células del cuerpo (excepto en los gametos) 46 cromosomas que se organizan en parejas, lo cual produce 23 pares de cromosomas llamados cromosomas homólogos. Durante la fertilización se combinan 23 cromosomas de la madre que se encuentran en el óvulo y 23 cromosomas del padre que se encuentran en el espermatozoide. Los cromosomas de los primeros 22 pares son llamados autosomas o cromosomas somáticos, mientras que los del último par son llamados cromosomas sexuales debido a que estos definen el sexo del nuevo individuo.
¿Sabía que…? El número de pares de cromosomas en cada especie es diferente. Por ejemplo, las moscas de fruta tienen 4 pares, es decir, 8 cromosomas en cada célula, la levadura tiene 16 pares y los helechos tienen más de 1200 cromosomas.
Actividad 1 (Plazo para enviarla del 11 al 22 de mayo)
Con base en la Lectura anterior desarrolle la siguiente situación y responda las preguntas.
Tengo un nuevo “brother”
1 Imagínese que tiene un nuevo hermano o hermana en casa. ¿Cómo cree que sería su aspecto físico?.Construya la imagen de este nuevo miembro de la familia dibujando su imagen a partir de las diferentes partes del rostro que encontrará a continuación. Dibuje a su “brother” en una hoja blanca.
2. Ya ha creado a su nuevo “brother”. Ahora responda a las siguientes preguntas:
a) ¿Cuáles rasgos tiene su “brother” que coinciden con características de su propio rostro?
b) ¿Por qué cree que su “brother” tiene rasgos similares a los de su rostro? o ¿por qué no?
ACTIVIDAD 2 (Plazo para enviarla del 11 al 22 de Mayo)
Lee el problema y, con base en él, realiza la actividad y responde las preguntas.
El pelaje de los perros labradores puede ser de tres colores: negro (N) que es el color dominante, Chocolate, que es recesivo (h) y dorado, que también es recesivo (n). Un criador de perros asegura que cruzó dos labradores de lineas puras, un macho negro con una hembra dorada.
http://www.colombiaaprende.edu.co/sites/default/files/naspublic/plan_choco/cien_9_b1_p1_est.pdf
http://www.colombiaaprende.edu.co/sites/default/files/naspublic/plan_choco/cien_9_b1_p2_est.pdf
Aulas Sin Fronteras-Bimestre1-Grado 9-Ciencias(18 de diciembre de 2017).¿Por qué soy diferente y único en el mundo?.
[Video].https://www.youtube.com/watch?v=GcZcWC8JurU&list=PLI1gOhfa4wv3zXhnBBY2VWywUDe7kBBhG&index=1
Aulas Sin Fronteras-Bimestre1-Grado 9-Ciencias(18 de diciembre de 2017). El síndrome de Down y la meiosis.
[Video].https://www.youtube.com/watch?v=_pNLc1SLWf0&list=PLI1gOhfa4wv3zXhnBBY2VWywUDe7kBBhG&index=2
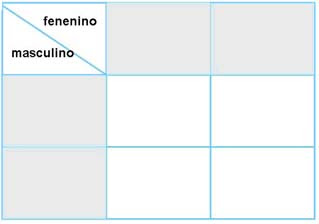
Aulas Sin Fronteras-Bimestre1-Grado 9-Ciencias(18 de diciembre de 2017).Construcción de Cuadros de Punnett.
[Video].https://www.youtube.com/watch?v=SZL6wFzWSl4&list=PLI1gOhfa4wv3zXhnBBY2VWywUDe7kBBhG&index=3
Aulas Sin Fronteras-Bimestre1-Grado 9-Ciencias(18 de diciembre de 2017).Determinación del sexo y ligamiento del sexo.
[Video].https://www.youtube.com/watch?v=VHuqXj_HQeM&list=PLI1gOhfa4wv3zXhnBBY2VWywUDe7kBBhG&index=4
Rodríguez, L...[et al]. (2012). Caminos del saber ciencias 8. Genética y Patrones Hereditarios, (págs. 78-79). Editorial Santillana.


















Este comentario ha sido eliminado por el autor.
ResponderBorrarcuando es la fecha de entrega
ResponderBorrarprofe en la prima 2 actividad hay q hacer la dibujar en el cuaderno o hacerlo en word o como
ResponderBorraren la actividad #2 hay que dibujar las celulas en el cuaderno o que hay que hacer?
ResponderBorrarA PARTIR DE QUE SE HACE LA TABLA
ResponderBorrarLes voy a pedir muy encarecidamente identificarse con nombre propio y grado si tiene una inquietud o va hacer un comentario, por ejemplo Unknown, que ha realizado varios comentarios anónimos y en varios grupos. Feliz tarde.
ResponderBorrarDibuje cada una de estas medias al lado de la pareja correspondiente (deben ser idénticas) y cree 22
ResponderBorrarpares de cromosomas somáticos. Dibuje y cree un último par de cromosomas sexuales, combinados de acuerdo con su sexo
biológico, así:
Mujer XX
Hombre XY
Alguien me puede ayudar
ME PUEDEN REGALAR LAS RESPUESTA
Borrar